

MOLÉCULAS
las moléculas mas simples,entre las cuales se encuentran las moléculas orgánicas,deben presentar un átomo central,en algunos casos el átomo central es el carbono,debido a su baja electronegatividad,luego que este queda rodeado por los demás átomos de otras moléculas.
MOLÉCULAS COMPUESTAS
en moléculas compuestas por varios átomos de un mismo elemento y un átomo de otro elemento distinto,este ultimo se realiza como el átomo central,lo cual representa en este diagrama con 4 átomos de hidrógeno y uno de silicio.el hidrógeno también es un elemento excepto puesto que no debe ir como átomo central.
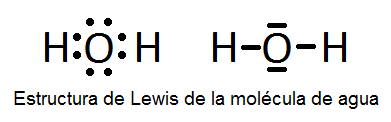
OPINIÓN PERSONAL:
lo que puedo entender por estructura de lewis es que son compuestos que forman enlaces con otros compuestos,aprendí que en la mayoría de estructuras de carbono es el centro de la estructura,por que tiene baja electronegatividad,también aprendí que hay otras estructuras y se elige un átomo central nunca H. generalmente es el menos electronegativo,se cuentan los electrones de valencia,los electrones restantes se sitúan como pares solitarios para completar octetos.
ESTADOS DE OXIDACIÓN
los compuestos químicos son estrictamente neutros,excepto los iones cuando los cunado los consideramos separadamente.es decir la carga que aportan los átomos de un compuesto tiene que ser globlamente nula, debemos tener en un compuestos tantas cargas positivas como negativas.respecto a los iones,se dice que quedan con carga residual.
para entender que significa esto de que un compuesto sea electricamente neutro,veamos un ejemplo:
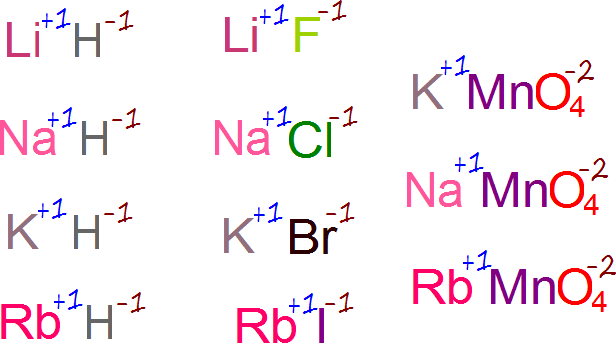
se refiere a los electrones que un elemento químico gana,pierde o comparte al formar un compuesto con otro átomo. también es un numero positivo negativo que evidencia .la capacidad que tiene un átomo para combinarse con otro.
REGLAS:
- el estado de O (oxigeno) es -2.
- el estado de H (hidrógeno) es +1.
- el estado de de un elemento libre es 0.
- su resultado en oxidación siempre va a ser 0.
- los elementos del grupo I siempre tiene numero de oxidación +1 y los del grupo II tiene numero de oxidación +2.
OPINIÓN PERSONAL:
lo que entendí de estados de oxidación es que un elemento químico gana,pierde o comparte con otro compuesto y con respecto a sus reglas es que si el compuesto esta solo su estado es 0 y la sumatoria algebraica siempre va a ser 0 por lo que hay que averiguar cual es el estado de oxidación del numero de que nos dan para que se resten y de 0.
LEY DEL OCTETO
 La regla de octeto o regla del octeto es un postulado que se
emplea en el contexto de la química. Se trata de la tendencia que evidencian
los átomos de completar su nivel energético con ocho electrones para alcanzar
estabilidad.
La regla de octeto o regla del octeto es un postulado que se
emplea en el contexto de la química. Se trata de la tendencia que evidencian
los átomos de completar su nivel energético con ocho electrones para alcanzar
estabilidad.
El científico estadounidense Gilbert Newton Lewis fue quien,
en 1917, postuló la regla de octeto. Lewis advirtió que, al combinarse entre
sí, los átomos intentan lograr la configuración estructural que tiene el gas
noble ubicado más cerca en la tabla periódica de elementos.
Al observar esta tabla, se puede advertir que los gases
nobles disponen de ocho electrones en su última capa. La deducción llevó a
Lewis a afirmar que esta configuración es la de mayor estabilidad para
cualquier clase de átomo.
La regla de octeto, en definitiva, indica que dos átomos
iguales, al enlazarse, desarrollan una organización específica para que, al
constituirse el enlace por la compartición de los pares de electrones, cada
átomo adquiera la estructura de un gas noble. Así, ambos átomos se encontrarán
rodeados de ocho electrones en su última capa energética.
OPINIÓN PERSONAL:
lo que entiendo al concepto de la regla del octeto que son átomos que se enlazan con otros átomos para completar ocho electrones de valencia para alcanzar el nivel energético para tener una estabilidad,estos átomos pueden llegar a compartir y no alcanzar lo necesario o alcanzar y tener mas de ocho electrones de valencia.
ENLACES QUÍMICOS
TIPOS DE ENLACES:
 Enlace iónico: Un enlace iónico se puede definir como la
fuerza que une a dos átomos a través de una cesión electrónica. Una cesión
electrónica se da cuando un elemento electropositivo se une con un elemento
electronegativo.
Enlace iónico: Un enlace iónico se puede definir como la
fuerza que une a dos átomos a través de una cesión electrónica. Una cesión
electrónica se da cuando un elemento electropositivo se une con un elemento
electronegativo.
 Enlace Covalente: El enlace covalente es la fuerza que une
dos átomos mediante la compartición de un electrón por átomo. Dentro de este
tipo de enlace podemos encontrar dos tipos: el enlace covalente polar y el
enlace covalente apolar.
Enlace Covalente: El enlace covalente es la fuerza que une
dos átomos mediante la compartición de un electrón por átomo. Dentro de este
tipo de enlace podemos encontrar dos tipos: el enlace covalente polar y el
enlace covalente apolar.
 Enlace Covalente Coordinado o Dativo: Si bien se clasifica
también como enlace covalente, algunos químicos difieren de llamarlo así debido
a que, como se dijo anteriormente, en un enlace covalente, los dos átomos que
forman dicho enlace aportan un electrón cada uno, es por eso que se le coloca
por separado.
Enlace Covalente Coordinado o Dativo: Si bien se clasifica
también como enlace covalente, algunos químicos difieren de llamarlo así debido
a que, como se dijo anteriormente, en un enlace covalente, los dos átomos que
forman dicho enlace aportan un electrón cada uno, es por eso que se le coloca
por separado.
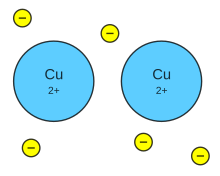 El enlace metálico
ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos
pierden electrones de sus capas mas externas, que se trasladan más o menos
libremente entre ellos, formando una nube electrónica (también conocida como
mar de electrones).
El enlace metálico
ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos
pierden electrones de sus capas mas externas, que se trasladan más o menos
libremente entre ellos, formando una nube electrónica (también conocida como
mar de electrones).
ENLACE COVALENTE
 El enlace covalente es la unión que como resultado de la compartición de uno o más pares de electrones se establece entre dos átomos. De
esta forma, distinguimos entre enlace simple o sencillo (los átomos comparten
un solo par de electrones), enlace doble (los átomos comparten dos pares de electrones) o enlace triple (los átomos
comparten tres pares de electrones).
El enlace covalente es la unión que como resultado de la compartición de uno o más pares de electrones se establece entre dos átomos. De
esta forma, distinguimos entre enlace simple o sencillo (los átomos comparten
un solo par de electrones), enlace doble (los átomos comparten dos pares de electrones) o enlace triple (los átomos
comparten tres pares de electrones).

ENLACE COVALENTE DATIVO
opinión personal:
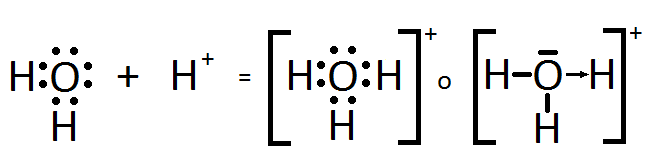
lo que entendí de enlace covalente dativo es que los átomos forman dicho enlace que aportan un electrón,este tipo de enlace se caracteriza por lo que solo comparten un átomo y otra característica es que el átomo acepta cuando un material necesita o carece de electrones un ejemplo de elementos que se pueden enlazar entre si son el oxigeno, nitrógeno y cloro.
ENLACES QUÍMICOS
Un enlace químico
corresponde a la fuerza que une o enlaza a dos átomos, sean estos iguales o
distintos. Los enlaces se pueden clasificar en tres grupos principales: enlaces
iónicos, enlaces covalentes y enlaces dativos. Los enlaces se producen como
resultado de los movimientos de los electrones de los átomos, sin importar el
tipo de enlace que se forme. Pero no cualquier electrón, puede formar un
enlace, sino solamente los electrones del último nivel energético (más
externo). A estos se les llama electrones de valencia. En este capítulo
analizaremos las características de cada tipo de enlace, como también veremos
diferentes maneras de representarlos en el papel. Partiremos definiendo lo que
es un enlace iónico.
TIPOS DE ENLACES:
 Enlace iónico: Un enlace iónico se puede definir como la
fuerza que une a dos átomos a través de una cesión electrónica. Una cesión
electrónica se da cuando un elemento electropositivo se une con un elemento
electronegativo.
Enlace iónico: Un enlace iónico se puede definir como la
fuerza que une a dos átomos a través de una cesión electrónica. Una cesión
electrónica se da cuando un elemento electropositivo se une con un elemento
electronegativo.  Enlace Covalente: El enlace covalente es la fuerza que une
dos átomos mediante la compartición de un electrón por átomo. Dentro de este
tipo de enlace podemos encontrar dos tipos: el enlace covalente polar y el
enlace covalente apolar.
Enlace Covalente: El enlace covalente es la fuerza que une
dos átomos mediante la compartición de un electrón por átomo. Dentro de este
tipo de enlace podemos encontrar dos tipos: el enlace covalente polar y el
enlace covalente apolar. Enlace Covalente Coordinado o Dativo: Si bien se clasifica
también como enlace covalente, algunos químicos difieren de llamarlo así debido
a que, como se dijo anteriormente, en un enlace covalente, los dos átomos que
forman dicho enlace aportan un electrón cada uno, es por eso que se le coloca
por separado.
Enlace Covalente Coordinado o Dativo: Si bien se clasifica
también como enlace covalente, algunos químicos difieren de llamarlo así debido
a que, como se dijo anteriormente, en un enlace covalente, los dos átomos que
forman dicho enlace aportan un electrón cada uno, es por eso que se le coloca
por separado.
OPINIÓN PERSONAL:
lo que entendí de enlaces químicos es que
es la fuerza que une dos átomos son iguales o distintitos hay distintos tipos
de enlaces los que conozco son enlaces simples y enlaces dobles, también hay
enlaces iónicos que es la fuerza que une dos átomos a través de una cesión
electrónica también hay enlaces
covalentes es la fuerza que une dos
átomos y solo se comparte un electrón y
por ultimo enlace dativo es llamado así por que aportan un electrón cada uno.
ENLACE METÁLICO
 El enlace metálico
ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos
pierden electrones de sus capas mas externas, que se trasladan más o menos
libremente entre ellos, formando una nube electrónica (también conocida como
mar de electrones).
El enlace metálico
ocurre entre dos átomos de metales. En este enlace todos los átomos envueltos
pierden electrones de sus capas mas externas, que se trasladan más o menos
libremente entre ellos, formando una nube electrónica (también conocida como
mar de electrones).
No Metales
Un metal típico es buen conductor de calor y de
electricidad, es maleable, dúctil, de apariencia lustrosa, generalmente sólido,
con alto punto de fusión y baja volatilidad.
Las propiedades físicas de los metales, principalmente la
conducción de electricidad, pueden ser explicadas por el enlace metálico. El
enlace metálico es un enlace covalente que tiene características propias.
Para entender bien un enlace covalente, precisamos pensar
primero en orbital atómico y luego en orbital molecular.
Un orbital atómico es fácil de comprender: es aquella región
del espacio donde existe la chance de encontrar un electrón en torno del núcleo
de un átomo. Como los núcleos de los átomos de diferentes elementos son
necesariamente diferentes, las energías de los orbitales atómicos van a variar
de elemento para elemento.
En tanto, cuando dos elementos tienen la condición propicia
para formar un enlace covalente, las energías de sus orbitales de valencia
serán razonablemente parecidas, y esos orbitales van a entrelazarse formando
una nueva región entre los núcleos de los átomos donde la energía será menor
aún, que aquellas de los orbitales de valencia de los átomos separados.
Esa región de baja energía, será el orbital molecular
enlazante. Es en el que el par de electrones responsables por el enlace
covalente va a residir, uniendo los dos elementos en una nueva molécula.
OPINIÓN PERSONAL:
Lo que entendí de enlaces metálicos es que
son enlaces electrónicos con los que se
mantienen unidos los metales los cuales
toman una forma cristalina en la que los
electrones forman una nube que mantienen unido el conjunto por lo que vemos
unido al metal de las ollas por estos en enlaces o de cualquier otro tipo de metal.
ENLACE COVALENTE
Según la T.E.V. (Teoría del Enlace de valencia) la compartición de electrones en un enlace
covalente se produce por el solapamiento de dos orbitales de dos átomos que
están semiocupados (en cuyo caso el spin del electrón de cada orbital ha de ser
antiparalelo) o de un orbital lleno y otro vacío. El enlace formado en este
último caso recibe el nombre de enlace covalente coordinado o dativo. En
cualquier caso, el solapamiento puede ser:
F Frontal: si
los dos orbitales atómicos se superponen enfrentados por sus extremos. El
enlace que se forma en este caso se denomina s
y la densidad electrónica es máxima entre los núcleos.
F Lateral: si
los dos orbitales atómicos se superponen paralelamente, de forma que la
densidad electrónica sea máxima por encima y por debajo de la línea
internuclear. Este enlace se denomina p, y es más débil (su energía de enlace
es menor).
OPINIÓN PERSONAL:
lo que entiendo por enlace covalente es que es un enlace que une a compuestos a través de la fuerza y tiene en común que solo comparte un electrón de esta forma distinguimos si el átomo es sencillo o doble hay dos tipos de enlaces covalentes polar y apolar
tiene una diferencia de elctronegatividad de menor a mayor.
tiene una diferencia de elctronegatividad de menor a mayor.
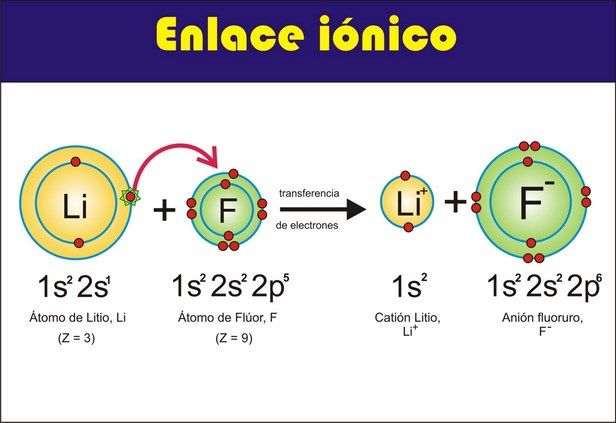
ENLACE IONICO
La atracción electrostática entre átomos de diferente carga
eléctrica genera un tipo de enlace conocido como enlace iónico. Es necesario
que para que pueda darse dicho enlace uno se los átomos pueda ceder electrones
y por el contrario el otro pueda ganar electrones, es decir, se produce la
unión entre átomos que pasan a ser cationes y aniones. Este tipo de enlace
generalmente se produce entre un elemento metálico (electropositivo) y elemento
no metálico (electronegativo). Un
ejemplo típico de este tipo de enlace lo
es el cristal iónico cloruro de
sodio ( NaCl ) sal común. En este enlace
tiene lugar la transferencia de un electrón del átomo de sodio al átomo de
cloro, como se observa a continuación:

OPINIÓN PERSONAL:
Lo que entendí de enlace ionico es un enlace atraves de una cesión electrónica y una cesión electrónica es cuando un elemento es electropositivo se une con un elemento electronegativo mientras mas sea la diferencia de electronegatividad el enlace ionico es mas fuerte un ejemplo puede ser el de Nacl.
Lo que entendí de enlace ionico es un enlace atraves de una cesión electrónica y una cesión electrónica es cuando un elemento es electropositivo se une con un elemento electronegativo mientras mas sea la diferencia de electronegatividad el enlace ionico es mas fuerte un ejemplo puede ser el de Nacl.
ENLACE COVALENTE DATIVO
Existe un tipo especial de enlace covalente en el cual, en
lugar de aportar un electrón cada átomo del enlace, los dos electrones son
aportados por el mismo átomo. Este tipo de enlace recibe el nombre de enlace
covalente coordinado o enlace covalente dativo.

También se puede representar el enlace covalente coordinado
con los diagramas o estructuras de Lewis, aunque es habitual hallarlo,
adicionalmente, encerrado entre corchetes, dado que habitualmente se trata de
iones poliatómicos.
Dos ejemplos de iones habituales que presentan enlace
covalente coordinado son el ion hidronio o hidrogenión (H3O+, el que se forma
cuando un ácido cede su protón, H+, en agua) y el catión amonio, NH4+ (que es
el resultado de que el amoníaco se comporte como base captando un H+).
Conviene tener en cuenta que no siempre las moléculas que
teóricamente se podrían formar utilizando este tipo de enlace, existen en la
realidad, ya que en ello intervienen también otros factores que aquí no hemos
tenido en cuenta, como por ejemplo, el tamaño de los átomos que van a enlazarse
y la propia geometría o forma de las moléculas.
opinión personal:
lo que entendí de enlace covalente dativo es que los átomos forman dicho enlace que aportan un electrón,este tipo de enlace se caracteriza por lo que solo comparten un átomo y otra característica es que el átomo acepta cuando un material necesita o carece de electrones un ejemplo de elementos que se pueden enlazar entre si son el oxigeno, nitrógeno y cloro.

No hay comentarios:
Publicar un comentario